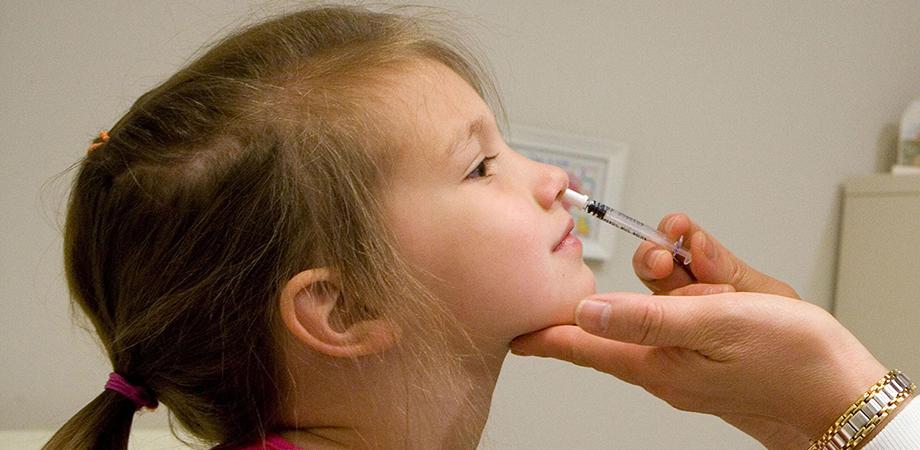
2月27日に第一三共の経鼻インフルエンザワクチン「フルミスト」が承認される見込み、との報道がありました。
承認されれば、当院でも今年の冬からはフルミストも使えるように準備する予定です。
10年近く前、このワクチンの日本への導入をお手伝いしていたので今回の承認は嬉しい限りです。
「注射をせずに鼻から「シュッ」とするだけでインフルエンザワクチンの接種ができるワクチン」という報道が多いようですが、これはフルミストの一面でしかありません。
このワクチンは今までのインフルエンザワクチンにはない優れたところがたくさんある、世界でただ1つのワクチンなのです。
フルミストが日本のインフルエンザワクチンと違う部分を、ちゃんと解説しておきたいと思います。
まず第1に、ワクチンに使っているインフルエンザウイルスの株は他の日本製のインフルエンザワクチンとは異なります(異なることがあります)。
そもそもフルミストの研究開発をしたのは第一三共ではなく、米国メドイミューン社(現在は英国アストラゼネカ社)です。第一三共は日本での開発を実施して日本への輸入と販売を行いますが、ワクチンの製造自体は今後も英国アストラゼネカ社の米国メドイミューン部門が実施します。
フルミストの製造は「マスターウイルスと野生株ウイルスを低温状況下で同時感染させて再集合化させる」という非常に特殊な技術を用いているので、メドイミューン社以外では製造できず、もちろん日本国内では製造することができません。
ところで、インフルエンザワクチンはA(H1N1)、A(H3N2)のA型2亜型とB(ビクトリア)、B(山形)のB型2型の4つのウイルス株の混合です。
ワクチンに使っているインフルエンザウイルス株は毎年違います。この株選定は毎年2月にWHOが前年の流行などをもとに使用する株リストを決めます。日本ではそのWHOのリストをもとに3月ぐらいに主に製造の際のウイルス増殖性やタンパク収量、生産性をもとに日本のワクチン製造に使用する株を決めます。
このため、WHO選定株と日本のワクチン製造株とが同じとは限りません。
例えばWHO は、2022/23 シーズンの北半球用のA(H1N1)pdm09 ワクチン推奨株として、A/Victoria/2570/2019 類似株を推奨していますが、日本では過去の製造実績から A/Victoria/1/2020 (IVR-217)を選定しています。
フルミストは米国で製造するワクチンですのでWHO選定株を使用して製造しますから、日本の選定株とは異なる可能性があります(もちろん同じ株が選ばれることもあり得ます)。
もっとも日本の株選定はWHO選定株をベースに製造効率を理由として株選定をしているので、必ずしも「日本の選定株の方が日本に適合性が高い」という訳ではありませんから、WHO選定株であっても問題はありません。
2つ目は、日本のインフルエンザワクチンは不活化コンポーネントワクチンであるのに対して、フルミストは弱毒生ワクチンであることです。
日本のインフルエンザワクチンは鶏卵を使ってインフルエンザウイルスを培養して、その後エーテルなどで不活化してワクチンに使うコンポーネントだけを取り出して作ります。この過程でウイルスの脂質成分などが除去されてしまうので、発熱などの副反応は少なくなりますが、抗体を作る力(免疫原性といいます)は弱くなります。
これに対してフルミストは弱毒生ワクチンなので、投与後に軽い感染をおこすため、鼻水や頭痛など軽い感冒様の症状が生じることがあります。
ただ、フルミストに使用されているウイルスはインフルエンザを発症させる力はないですし、もちろん、他の人に感染して病気を発症することはありません。フルミストのウイルスは投与された人から検出されないことは長年にわたって調査・実証されています。
3つめは投与方法の違いです。フルミストは経鼻噴霧、日本のワクチンは皮下投与になります。
フルミストは点鼻投与後に弱毒ウイルスが鼻咽頭の粘膜に感染を起こすので、血中にウイルス中和抗体であるIgG抗体を形成するだけではなく、鼻咽頭の粘膜面に分泌型抗体であるIgAを作ります。
IgGは血中抗体であるため血中にウイルスが入れば結合して中和できますが、粘膜面には分泌されないので、インフルエンザウイルスが鼻腔や咽頭の粘膜部位に吸着した段階では結合することができず、十分に働くことができません。
でも、IgA抗体は分泌型抗体で粘膜面に分泌されるため、鼻腔にウイルスが入ってきた時に粘膜面で結合して体内に入らないようにすることができます。このためフルミストには重症化予防効果はもちろんですが、感染予防効果があります。
また、感染によって細胞性免疫を誘導できるので、投与したワクチン株と実際に感染してきたウイルスの型が少々違っても感染防止をすることができます。
インフルエンザワクチン株は前年の流行をもとに決定されるため、必ずしも今年の流行株とは一致していないことがあるので、少々の型の不一致があっても有効性を示せるのはとても重要です。実際、フルミストの発症予防効果は驚異的に高く、5歳未満児における発症予防効果は株が一致した場合には89.2%、株不一致の場合であっても79.2%です。
これに対して、日本のインフルエンザワクチンは皮下投与ですので、中和抗体であるIgG抗体を作ることはできますが、粘膜面にIgA抗体を作ることはできませんし、細胞性免疫の誘導効果はほぼありませんから型が合わないと効果は低下します。また、稀にですがアレルギーの原因となるIgE抗体を作ってしまうこともあります。
一般的に呼吸器のウイルス感染症の皮下投与/筋肉内投与のワクチンが「重症化予防効果はあるけれど、感染予防効果はない/少ない」のはIgA抗体を作ることができないためです。
実はmRNA型の新型コロナワクチンも同じで、mRNA型ワクチンは血中抗体価=IgG抗体の産生能力は高いので重症化阻止はできますが、IgAの産生能力は全くないので、感染予防効果はありません。「mRNA型ワクチンを何回も打ったのに新型コロナに感染した」人がいたのはこのためです。この話はまた別の記事に書きますね。
4つ目は、2つ目、3つ目の点とリンクするのですが、「大人よりも子供で効果が高い」ことです。
日本のインフルエンザワクチンは「子供は2回接種、大人は1回接種」なのはご存じのとおりです。子供はインフルエンザにかかったことがないか少ないので、ワクチンだけで十分な免疫をつけるためには1回接種では足りず、2回接種が必要ですが、大人は過去にインフルエンザに罹患した経験があることが多いので、1回接種で既存の免疫をブーストするだけで充分だからです。
インフルエンザに感染したことがない(か少ない)子供の場合には、鼻腔咽頭面にIgAがありませんから、鼻腔投与したワクチン株ウイルスは十分に感染を成立させることができて、強力な免疫、IgA=局所免疫、IgG=血中中和抗体、細胞性免疫=型違いのウイルスへの効果、を作ることができます。
このためフルミストは十分に強い感染予防効果を示すことができます。
でも、大人の場合には、感染経験の自覚のあるなしにかかわらず、過去にインフルエンザに感染したことがあるのが普通ですから、一定のインフルエンザ抗体を持っていることが普通です。
このように既に免疫を持っている人に経鼻的にワクチンを投与した場合、既存の免疫がワクチンウイルスを排除してしまうため、十分な感染が成立しないことが多く、その結果、ワクチンとしての効果が弱くなってしまいます。
このため、フルミストは子供には安定して優れた効果があるけれど、大人では効果が弱くなってしまうことが知られており、また、子どもであっても何年も同じワクチン株を選定した場合には効果が低下する可能性があります。
実際、米国では接種可能年齢は「49歳まで」とはなっていますが、子供の方が有効性が高いので、CDCがフルミストを推奨しているのは「6か月〜18歳までの小児・若年者」です。日本でも対象年齢は「2歳以上19歳未満」となっています。
アメリカの方が接種可能年齢が広いのはアメリカ特有の事情によります。
アメリカは国民皆保険ではないので、無保険の人が多くいますし、子育て中の若い人達は「カバーできる範囲は狭いが保険料が安い」保険に入っていることも多いのです。このため医療費が高額になりますし、また、インフルエンザに罹患したとしても、高価な抗インフルエンザ薬を使用することはほとんどありません。また、国土が広いので医療機関に気軽に受診できない環境の人も多く、医療機関の受診予約は1か月後、なんていうことも珍しくない国です。ですから、「予防できる病気はワクチンを打って予防する」ことが重要なので、ドラッグストアを兼ねた薬局で薬剤師やナースプラクティショナー(特別看護師)がワクチン接種をすることも一般的です。
このような医療環境なので、「子供がフルミストを接種した時についでに親も一緒に接種することができる」ように米国では49歳までが接種可能年齢に設定されています。でも有効性が既存のワクチンに比べて高いのは若年層であることは明らかなので推奨年齢は小児・若年者とされているのです。
これに対して、日本は国民皆保険ですから、「インフルエンザに罹ったら医療機関を受診して抗インフルエンザ薬をもらう」ことが一般的です。実は世界中のタミフルをはじめとする抗インフルエンザ薬の75~80%は日本で消費されています。
日本では「効果が既存薬と同等か優れた新規医薬品/ワクチンのみ承認する」ことが原則なので、フルミストの適用年齢も19歳未満の小児・若年者となっているのです。
5つ目は、弱いとはいえ感染を起こすため、免疫が低下している人、特にCD4細胞が低下している人にフルミストは使えませんから注意が必要です。これは他の生ワクチンと同じですね。
ところで、ネットの書き込みには「コロナワクチンは短期間で承認したのに、フルミストの承認には7年もかかっている」ことを揶揄するコメントも散見されますが、フルミストの承認に時間がかかったのはちゃんとした理由があると思われます。
1つ目はワクチン株ウイルスがフルミスト(WHO株)と対照ワクチン(国内株)で違ううえに、フルミストは細胞性免疫誘導効果があるため型違いのインフルエンザウイルスに対しても感染防御効果を示してしまうことから有効性評価のためには型がマッチした感染者数が一定以上必要なのですが、治験期間中の流行株とワクチン株がそもそもミスマッチだったために十分な数のマッチ症例が集まらなかったので、有効性評価が難しかったのでしょう。
2つ目は前述の4つ目のポイントに関連することが実際に起きてしまったことが影響したのでしょう。実は2016~2018年の間、米国疾病管理予防センター(CDC)の予防接種諮問委員会(ACIP)は、「フルミストの効果が低下した可能性がある」ことを理由に接種推奨をしませんでした。米国において2015/16、2017/18シーズンの流行の主流はAH1pdm09だったのですが、2015/16シーズン用フルミストのワクチン効果は一般的な皮下接種不活化ワクチンと比べて有意に低かったという報告があり、特にAH1pdm09に対してはほとんど効果がなかった、とまでいわれました。このため米国では接種推奨が取り下げられてしまったのです。この後、アストラゼネカ社が再度臨床試験を行って有効性確認ができたため2018/2019シーズンには再び接種推奨となりました。
これは「ワクチンのウイルスがすでに持っていた抗体によって排除されてしまった」ことが主な原因で生じた事象だ、と言われています。
これらの米国でのできごとがちょうど日本での承認申請期間中の出来事であったため、有効性評価に手間取り、承認に時間がかかってしまったと思われます。インフルエンザの臨床試験は流行期が限られているために年に1回しか実施のタイミングがないので、どんなに急いでも準備から結果が出るまで1~2年以上かかってしまいますから、他のワクチンや薬に比べてデータをそろえるのに非常に長い時間がかかるのです。
また、海外ワクチンを導入することで国内ワクチンメーカーの採算が悪化して国内製造をやめたり減らしたりすると、国内で需要が増加した時に増産できなくなると困るので、海外ワクチンの導入には慎重になる傾向があります。
実際には日本のワクチン技術は既に世界的には遅れてしまっていますし、「日本のワクチンを使おう」という国は世界中にないのが現実なのですが、いまだに「日本のワクチンは世界的にも優秀だ」と思っている方もいるので、まあ海外ワクチンを日本に持ってくるということはとても大変なことなのです。この話も別の記事にして書きますね。
この他、フルミストはマスターウイルスと野生株との再集合化によって作られる弱毒ウイルスであるため遺伝子組み換えウイルスに該当するので、国をまたいだ移動(要するに輸出入)の規制対象になりますし、国内選定株とWHO選定株の相違があるため規格の決定など諸手続きにも手間がかかったはずです。
これらのためにフルミストの承認までに時間がかかってしまったのでしょう。
このようにいろいろな相違点はありますが、フルミストは子供~若年者にとっては非常に高い感染予防効果を示す優れたワクチンです。
今年の冬から使えるようになるのを楽しみにしておきましょう。